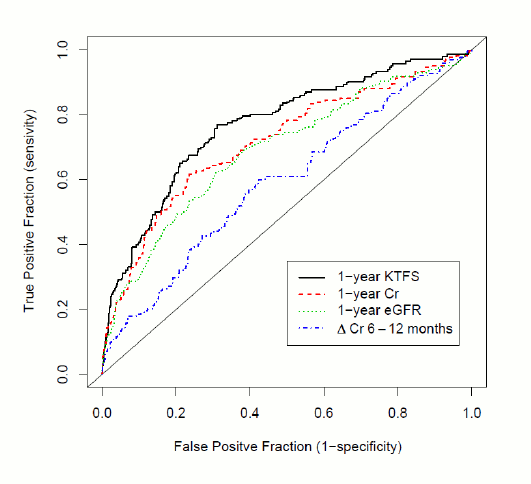
< Previous
Les études des facteurs potentiellement associés à la survie des patients transplantés sont quasiment toutes basées sur l’estimateur de Kaplan-Meier et/ou sur le modèle de Cox. Ces méthodes permettant l’étude du temps d’apparition d’un événement unique, trois choix de variables à expliquer sont possibles pour les études de survie en transplantation rénale : (i) le délai entre la greffe et le retour en dialyse (les décès avec un greffon fonctionnel sont alors des censures à droite), (ii) le délai entre la greffe et le décès avec un greffon fonctionnel (les retours en dialyses sont alors des censures à droite) et (iii) le délai entre la greffe et le premier des deux échecs possibles. La première solution est critiquable puisqu’un nombre non-négligeable de décès est dû à la greffe. L’équipe a d’ailleurs montré l’augmentation du risque de cancers dus aux traitements immunosuppresseurs. La surestimation de la survie qui en découle n’est pas le seul problème de cette approche. En effet, le modèle de Cox suppose une indépendance entre le processus de censure et le temps de survie étudié. Cette hypothèse est difficilement acceptable puisque le niveau de la filtration glomérulaire est lié à de nombreuses comorbidités. Les deux autres choix sont à l’inverse les plus pessimistes. Ils considèrent tous les décès comme liés à la transplantation alors que beaucoup d’entre eux sont indépendants de la pathologie étudiée.
Prenons un exemple concret avec le lien entre l’âge du receveur à la greffe et l’évolution du patient transplanté. Beaucoup d’études montrent que la survie du patient-greffon ou celle du patient sont plus faibles chez les plus vieux receveurs. Il est cependant attendu que les receveurs âgés présentent une mortalité plus importante. Au centre des travaux de Hernandez et al., l’âge du receveur est ainsi le facteur le plus important dans la construction d’un score de prédiction de la mortalité des patients transplantés. En revanche, si l’on s‘intéresse uniquement à la survie du greffon (censure des décès avec un greffon fonctionnel), beaucoup d’études montrent l’absence de lien avec l’âge du receveur.
Application à la cohorte DIVAT
A partir de DIVAT (Données Informatisées et VAlidées en Transplantation, Nantes, Nancy, Paris Necker, Toulouse et Montpellier), nous avons construit les deux modèles pour illustrer ces propos (Table 1). Alors qu’il semble que la survie du greffon-patient soit inférieure chez les receveurs âgés (p<0.0001), on ne peut pas conclure à ce lien avec la survie du greffon (p=0.1832). L’interprétation la plus simple de ces résultats est que l’âge est naturellement associé à la mortalité et que cette relation explique le lien avec la survie du greffon-patient. En termes d’allocation de greffon, ceci sous-entend que la greffe rénale des personnes âgées ne semble pas contre indiquée. Cette conclusion est bien entendue valide si on fait l’hypothèse que la plus grande part de la mortalité est indépendante de la transplantation. Cependant, on est aussi en droit de penser qu’une partie de la mortalité est due à la greffe. Ainsi, le modèle analysant la survie du greffon peut sous-estimer l’effet de l’âge puisque tous les décès sont censurés, qu’ils soient dépendants ou non de la greffe. Une solution serait de censurer uniquement les décès indépendants de la greffe, mais la cause du décès est souvent méconnue ou non-attribuable. Si on reprend le cas des cancers, comment définir s’il est dû à la greffe ou s’il aurait eu lieu de toute façon ? Pour résoudre indirectement cette question, nous avons utilisé les modèles de survie relative. Ils permettent, en utilisant les tables de mortalité de la population générale française, d’étudier indirectement l’excès de mortalité des transplantés rénaux. Cet excès de mortalité peut être dû à la greffe, mais aussi à l’insuffisance rénale de manière plus générale. En reprenant le modèle multivarié de la Table 1, on a étudié le risque de retour en dialyse et de décès lié à la transplantation. Le risque relatif est égal à 1.38 (p=0.0041) pour l’âge du receveur à la greffe. A partir de cet exemple, on montre que le modèle de survie relative peut être vu comme une synthèse des deux modèles de Cox extrêmes précédents. Comme le montre la Figure 1, cette synthèse concerne aussi les autres variables.
Table 1 – Résultats multivariés selon le temps de survie étudié à partir d’un modèle de Cox (DIVAT, n=4280). Les modèles ont été construits séparément. Si une variable était significative dans un des modèles, elle a alors été incluse dans les autres modèles pour pouvoir comparer les résultats.
|
Risque Relatif (p-value)
|
Survie patient/greffon
|
Survie greffon
|
|
Age du receveur (> 55 vs < 55 ans)
|
1.58 (0.0001)
|
1.17 (0.1832)
|
|
Age du donneur (> 55 vs < 55 ans)
|
1.52 (0.0001)
|
1.40 (0.0055)
|
|
Ischémie froide (>36 vs < 36 heures) †
|
|
|
|
- Avant 7 ans de transplantation
|
1.14 (0.3895)
|
0.98 (0.9224)
|
|
- Après 7 ans de transplantation
|
1.83 (0.0181)
|
2.68 (0.0011)
|
|
Sexe du receveur (hommes vs femmes)
|
0.94 (0.4512)
|
0.78 (0.0172)
|
|
Dialyse post-opération (oui vs non)
|
1.76 (0.0001)
|
1.88 (0.0001)
|
|
Rejet aigu (oui vs non) *
|
1.76 (0.0001)
|
2.44 (0.0001)
|
La mortalité relative des patients transplantés par rapport aux patients dialysés
Nous ne sommes pas les premiers à étudier les différences de survie entre transplantés rénaux et patients en dialyse. Le problème majeur est la comparabilité des deux groupes puisqu’aucun essai clinique randomisé n’a jamais été réalisé pour montrer la supériorité d’un groupe par rapport à l’autre. Les patients dont le pronostic attendu est le meilleur (jeunes, pas de comorbidité comme le diabète, etc.) sont ceux qui reçoivent préférentiellement une greffe. Dans les années 70, les premières études présentaient ainsi des lacunes méthodologiques importantes puisqu’elles confondaient l’effet de la greffe et celui de la sélection des patients greffés. Seules quelques études tentaient de limiter ce biais. Par exemple, Kjellstrand et al. ont exclu les patients hypertendus et diabétiques de l’analyse pour obtenir des groupes plus comparables. Hutchinson et al. font partie des premiers à avoir réellement pris en compte ces facteurs de confusion en utilisant un modèle de Cox multivarié. La limite méthodologique majeure de ce type de travail reste néanmoins le choix de l’origine de l’étude : (i) le jour de la greffe pour les patients transplantés et le jour de la première dialyse pour les autres. Ce type d’analyse sous-tend que les patients greffés aient déjà survécu jusqu’à la date de greffe (troncature à gauche) ce qui biaise toujours la comparabilité des groupes. (ii) le jour de la première dialyse pour les deux groupes, alors que tous les sujets sont en dialyse à l’origine.
A notre connaissance, ce n’est qu’en 1999 avec l’étude américaine de Wolfe et al. que ce biais a été contrôlé avec l’utilisation d’un modèle de Cox où l’effet de la greffe sur la mortalité est modélisé par une variable explicative dont la valeur dépend du temps. Ce modèle permet d’évaluer l’effet de la greffe à partir du moment où elle a lieu en ajustant par les potentiels facteurs de confusion. Les auteurs ont proposé aussi des critères d’inclusion favorisant la comparabilité des groupes : seulement les transplantés de moins de 70 ans (très peu de patients sont greffés au delà de cette limite) avec au moins une dialyse (exclusion des greffes préemptives) et avec un greffon de donneur cadavérique. De plus, seuls les patients inscrits sur liste d’attente étaient inclus. Plus de 23 000 receveurs suivis dans le registre américain UNOS (United Network for Organ Sharing) ont finalement été retenus. Les greffes de donneurs vivants étaient censurées. Ce registre a permis l’ajustement des résultats sur l’âge, l’ethnie, la cause de l’insuffisance rénale (glomérulonéphrite, diabète ou autre), l’année d’enregistrement sur liste d’attente et la région géographique. L’analyse a été menée en intention de traiter, autrement dit, les patients n’étaient pas exclus de l’analyse si on les enlevait des listes d’attente.
Cette approche est importante car la plupart des décès en dialyse ont lieu alors que les patients ont été exclus de la liste suite à la dégradation de leur état. A partir de cette méthodologie, les auteurs ont montré que pendant les 15 jours suivant la greffe, le risque de décès est 2.8 fois plus important que celui des patients restés en dialyse. Ce risque reste supérieur à 1 pendant les 106 premiers jours de la greffe puis il s’inverse. Ce n’est qu’après le 244ème jour que la survie devient plus faible dans le groupe des dialysés. Après 3 ans de transplantation, les patients en dialyse ont plus de 3 fois plus de risque de décéder que les patients avec un greffon fonctionnel (p<0.0001). Ce risque relatif a aussi été calculé dans de nombreux sous-groupes définis par les facteurs d’ajustement. Ainsi, les auteurs ont montré que le plus fort risque relatif (RR=4.1) est estimé pour les patients entre 20 et 39 ans au moment du placement sur liste d’attente. Ces différences entre classes d’âge sont aussi modifiées selon le statut diabétique. Aucune différence n’est visible entre les hommes et les femmes ou selon les causes de l’insuffisance rénale.
La même méthodologie avait été adoptée par Schnuelle et al. en Allemagne mais il s’agissait d’une base de données locale. Beaucoup d’études ont ensuite été proposées pour valider les résultats de Wolfe et al. dans d’autres pays que les USA. La population américaine est en effet particulière avec une forte proportion de diabétiques et avec un taux de mortalité très important. Rabbat et al. au Canada ont également publié ce modèle en choisissant un risque relatif différent sur trois intervalles de temps (dialyse comme groupe de référence) : de 0 à 30 jours (RR=2.91), de 30 jours à 1 an (RR=0.85) et à plus long terme (RR=0.25). On peut aussi citer les études australiennes ou suédoises.
Les apports de la survie relative
La méthodologie employée dans les travaux précédents minimise les biais grâce à deux stratégies. Premièrement, seuls les patients éligibles à la greffe sont inclus. Deuxièmement, l’origine de l’étude est la même pour tous les sujets et elle correspond à la première dialyse, la greffe est modélisée comme une variable dont la valeur et l’effet dépendent du temps. Cependant, il existe toujours certaines sources de biais :
- Le nombre de facteurs d’ajustement est limité. On sait que la décision de transplantation dépend aussi d’autres paramètres comme les antécédents cardiovasculaires ou néoplasiques. Rabbat et al. insistent sur ce point dans leur discussion.
- Seules les variables à la fois liées à la dialyse et à la greffe peuvent être analysées. Par exemple, on ne peut pas quantifier le gain de mortalité en greffe selon l’âge du donneur : sa valeur est par définition manquante pendant le suivi de l’individu sur liste d’attente. En respectant la stratégie des articles précédents, seule une analyse en sous-groupe selon l’âge du donneur serait possible. On comparerait alors les risques relatifs liés à la greffe et les intervalles de confiance associés. Cette stratégie est synonyme de perte de puissance. De plus, aucun test d’inférence ne peut être réalisé pour évaluer l’impact de l’âge du donneur. Enfin, les résultats seraient biaisés en sélectionnant les patients dès la première dialyse en fonction de l’âge du donneur qui n’est pas indépendant des caractéristiques du receveur.
- Les bases de données relatives aux suivis en dialyse sont souvent différentes de celles relatives aux suivis des transplantés. Il n’y a alors pas de clef d’identification unique. De plus, il est légalement difficile de réaliser des jointures nominatives. Que ce soit du point de vue technique ou réglementaire, reconstruire des trajectoires individuelles est souvent problématique.
- Suite à l’article de Wolfe et al., tous les auteurs s’intéressant au sujet ont utilisé la même méthodologie en justifiant leur étude par la particularité de leur pays/région par rapport à l’étude américaine : Canada, Suède, ou Ecosse. Cette dépendance régionale des résultats soulève la question d’une étude française et de la validité universelle des résultats.
L’objectif clinique de notre projet est d’identifier les facteurs liés à la survie relative des patients transplantés rénaux en comparaison aux patients en dialyse. Les modèles de survie relative constituent une alternative intéressante aux modèles couramment utilisés. L’idée est de modéliser la mortalité spécifique d’un patient transplanté en enlevant la mortalité d’un patient comparable en dialyse (même âge, même sexe, mêmes comorbidités, etc.). Ce modèle devrait permettre d’apporter des solutions aux limites précédemment abordées :
- Les modèles de survie relative ne nécessitent pas la réunion de deux bases de données. On construit d’abord des tables de mortalité en dialyse. Ces tables, où l’information concernant la mortalité est alors agrégée, sont ensuite utilisées lors de l’étude de la mortalité observée en transplantation. Les extractions des bases de données peuvent ainsi être anonymes car elles ne seront pas jointes.
- Schématiquement, la mortalité spécifique en transplantation est obtenue en retranchant la mortalité attendue en dialyse à celle observée en transplantation. Cet ajustement est réalisé pour chaque transplanté en fonction d’un grand nombre de paramètres de confusion liés à la sélection des patients ayant le meilleur pronostic pour la greffe : l’âge, le sexe, la région, la maladie rénale initiale (glomérulonéphrite, diabète, autres), les antécédents cardiovasculaires, les antécédents de néoplasie, les antécédents d’hypertension, les antécédents de diabète, la technique d’épuration pré-greffe, l’année de mise sur liste d’attente et le temps entre la première dialyse et l’inscription sur liste d’attente. Le nombre de facteurs d’ajustement est largement supérieur aux études précédemment citées qui ne prennent généralement en compte que l’âge, le sexe, la maladie initiale et le temps entre la première dialyse et l’inscription sur liste d’attente.
- L’origine du temps de suivi est la greffe. Il est donc possible d’analyser tous les facteurs de risque spécifiques ou non spécifiques à la transplantation. Il s’agit d’une réelle analyse multivariée et pas d’une analyse stratifiée en sous-groupe.
- En prenant en compte la mortalité attendue en dialyse, on prend aussi en compte la mortalité du pays étudié. Les résultats de ce modèle sont donc par définition plus robustes à l’hétérogénéité de la mortalité entre pays ou continents.
-
Alors qu’il n’est pas possible de distinguer la causalité entre la greffe et certains décès, ce modèle de survie relative permet indirectement d’étudier la mortalité spécifique à la transplantation. Nous pourrons ainsi envisager deux modèles différents :
- Etude du temps entre la greffe et le décès du patient.
- Etude du temps entre la greffe et le premier évènement (retour en dialyse ou décès du patient).